martes, 14 de noviembre de 2017
viernes, 3 de noviembre de 2017
martes, 31 de octubre de 2017
SEMANA #34
hicimos un quiz de normalidad y moralidad
se vino a sala y se trabajo en el ova, en el blog
LA SOLUBILIDAD: Es la cantidad máxima de soluto que puede disolverse en una cantidad determinada de solvente a una temperatura previamente establecida. Generalmente, la solubilidad de una sustancia se expresa en gramos del soluto por cada 100 gramos de disolvente, por ejemplo, a 20 0C, la máxima cantidad de cloruro de sodio que se puede disolver en 100 gramos de agua son 36,0 gramos. En la siguiente tabla podemos observar la solubilidad de NH4NO3(nitrato de amonio), C6H12O6(Glucosa), NaNO3(nitrato de sodio), CH3CO2Na(acetato de sodio), LiCl(cloruro de litio), KBr(bromuro de potasio), NH4Cl(cloruro de amonio), CuSO4(sulfato de cobre II), NaCl(cloruro de sodio) y por último el Ce(SO4)3 (sulfato de cerio III).


se vino a sala y se trabajo en el ova, en el blog
LA SOLUBILIDAD: Es la cantidad máxima de soluto que puede disolverse en una cantidad determinada de solvente a una temperatura previamente establecida. Generalmente, la solubilidad de una sustancia se expresa en gramos del soluto por cada 100 gramos de disolvente, por ejemplo, a 20 0C, la máxima cantidad de cloruro de sodio que se puede disolver en 100 gramos de agua son 36,0 gramos. En la siguiente tabla podemos observar la solubilidad de NH4NO3(nitrato de amonio), C6H12O6(Glucosa), NaNO3(nitrato de sodio), CH3CO2Na(acetato de sodio), LiCl(cloruro de litio), KBr(bromuro de potasio), NH4Cl(cloruro de amonio), CuSO4(sulfato de cobre II), NaCl(cloruro de sodio) y por último el Ce(SO4)3 (sulfato de cerio III).


SEMANA #33
¿QUÉ ES UNA DISOLUCIÓN?
Una disolución es una mezcla homogénea, es decir, una mezcla de 2 o más componentes que no reaccionan entre sí, es decir, que siguen siendo los mismos después de mezclados, y además por ser homogénea no se ven o diferencian sus componentes después de mezclados a simple vista.Pero entonces... ¿Qué diferencia hay entre una mezcla homogénea y una disolución?.
Pues bien cuando en la mezcla homogénea uno de los dos componentes es líquido, normalmente agua, esta mezcla homogénea es a lo que se le suele llamar disolución. Las disoluciones químicas suelen estar en estado líquido.

EJEMPLO DE DISOLUCION
| Estado del soluto | Estado del solvente | estado de la solución | Ejemplos |
| Gas | Gas | Gas | Aire (O2 y N2 ) |
| Gas | Líquido | Líquido | Agua mineral (CO2 y H2O) |
| Gas | Sólido | Sólido | Hidrógeno en paladio |
| Líquido | Gas | Gas | No existen ejmplos |
| Líquido | Líquido | Líquido | Bebidas alcohólicas |
| Líquido | Sólido | Sólido | Amalgamas (Hg y Au) |
| Sólido | Gas | Gas | No existen ejemplos |
| Sólido | Líquido | Líquido | Azúcar o sal en agua |
| Sólido | Sólido | Sólido | Aleaciones Cu-Zn forman bronce |
SEMANA #32
1. Cuáles son las características de una solución?
-Están formados por dos componentes: soluto y solvente.
-Las partículas de soluto tienen menor tamaño que en las otras clases de mezclas.
-Presentan una sola fase, es decir, son homogéneas.
-Si se dejan en reposo durante un tiempo, las fases no se separan ni se observa sedimentación, es decir las partículas no se depositan en el fondo del recipiente.
-Son totalmente transparentes, es decir, permiten el paso de la luz.
2. Cuáles son sus componentes?
Soluto: es la sustancia que se encuentra en menor cantidad, aquella que se disuelve en la mezcla. Con frecuencia cambia de estado. Una solución puede contener varios solutos.
Solvente (también llamado disolvente): es la sustancia que se encuentra en mayor cantidad, aquella en la que se disuelve el soluto. Esta sustancia no cambia de estado.
Saturadas; hay un equilibrio entre el soluto y el solvente
Sobre saturadas; existe un exceso de soluto y se agota la propiedad del solvente de disolver el soluto.
3. Mencione otros disolventes diferentes al agua que se pueden utilizar en soluciones
etanol
acetona
el eter
4. Qué es la solubilidad y que factores la afectan?
es la máxima cantidad de una sustancia que es posible de disolver en una determinada cantidad de solvente
FACOTORES
-temperatura
presencia de otro soluto
agitación
presión
5.
A qué se llaman soluciones empíricas y como se dividen?
Una solución empírica es aquella solución que no posee una concentración determinada, siendo distinta a las soluciones valoradas, a las cuales si se les conoce la concentración exacta en términos de molaridad, normalidad, molalidad, osmolaridad y concentraciones porcentuales.
-solución diluida-solución concentrada
-solución saturada
-solución sobre saturada
6.
Que son las soluciones valoradas y cuales se mencionan en el vídeo?
Las soluciones valoradas o soluciones estándar son aquellas en las que las medidas de concentración de sus componentes son conocidas y seguidas con precisión. Las medidas de concentración están estandarizadas.
-soluciones porcentuales
-soluciones molares
Las soluciones valoradas o soluciones estándar son aquellas en las que las medidas de concentración de sus componentes son conocidas y seguidas con precisión. Las medidas de concentración están estandarizadas.
-soluciones porcentuales
-soluciones molares
martes, 24 de octubre de 2017
SEMANA #31
PREGUNTAS DEL OVA SOBRE SOLUCIONES
¿Que contiene el aire ?
OXIGENO, NITRÓGENO, ARGÓN En unas proporciones del 21%, 78% y 1%, respectivamente
3)¿QUÉ FORMA EL BRONCE?
Se produce mezclando Cobre y Estaño
4)¿QUÉ TIENEN LOS LIMPIADORES?
-Hidrocarburos halogenados
-Hidrocarburos
-Hidrocarburos Oxigenados
-Gases comprimidos
OBSERVA LAS IMÁGENES Y TRATA DE RESPONDER LO PLANTEADO.





¿Que contiene el aire ?
OXIGENO, NITRÓGENO, ARGÓN En unas proporciones del 21%, 78% y 1%, respectivamente
3)¿QUÉ FORMA EL BRONCE?
Se produce mezclando Cobre y Estaño
4)¿QUÉ TIENEN LOS LIMPIADORES?
-Hidrocarburos halogenados
-Hidrocarburos
-Hidrocarburos Oxigenados
-Gases comprimidos
OBSERVA LAS IMÁGENES Y TRATA DE RESPONDER LO PLANTEADO.





SEMANA #29
se repasan las leyes ponderales
Las Leyes Ponderales:
Las Leyes Ponderales o Gravimétricas son un grupo de Leyes que estudian las reacciones químicas en función de las cantidades de materia de los diferentes elementos que intervienen.
Las Leyes Ponderales:
Las Leyes Ponderales o Gravimétricas son un grupo de Leyes que estudian las reacciones químicas en función de las cantidades de materia de los diferentes elementos que intervienen.
SEMANA #28
LABORATORIO.
Durante esta semana realizamos la practica de laboratorio y observamos los metodos de separacion. Para el laboratorio se elaboró un informe.
y su objetivo es enseñarnos todas los metodos de separacion
Durante esta semana realizamos la practica de laboratorio y observamos los metodos de separacion. Para el laboratorio se elaboró un informe.
y su objetivo es enseñarnos todas los metodos de separacion
SEMANA #27
Metodos de Separación de Mezclas.
SEPARACIÓN MAGNÉTICA





SEPARACIÓN MAGNÉTICA
Habrás pensado que la forma más rápida y efectiva de separar el hierro del aluminio es recurrir a un imán (si no tuvieras ninguno podrías improvisarlo, ya que muchos cierres de bolsos y tapas de carcasas protectoras de móvil son imanes). Puesto que el hierro es atraído por el imán pero el aluminio no, habrás solucionado el problema de una manera sencilla.
El método empleado en este caso para separar los componentes de tu mezcla heterogénea recibe el nombre de separación magnética. Solo puede emplearse si uno de ellos presenta propiedades magnéticas (como el hierro) y el resto no.

DECANTACIÓN

DECANTACIÓN
SE EMPLEA PARA SEPARAR LÍQUIDOS CON DENSIDADES DIFERENTES Y QUE NO SE MEZCLAN ENTRE SÍ (INMISCIBLES), COMO EL AGUA Y EL ACEITE. EN ESTOS CASOS, SE UTILIZA UN EMBUDO DE DECANTACIÓN.

FILTRACIÓN
Este método se usa para separar un sólido de un líquido en el cual no se disuelve (no es soluble en él), como la arena en suspensión en el agua. Para ello, se hace pasar la mezcla heterogénea a través de un filtro con un tamaño de poro adecuado (menor que el de las partículas que queremos separar). Habitualmente se emplea un papel de filtro acoplado a un embudo.

DESTILACIÓN
Se utiliza para separar líquidos solubles entre sí que tienen temperaturas de ebullición muy diferentes, como el agua y el alcohol.
La mezcla se vierte en un matraz esférico (o de fondo redondo) y se calienta. Cuando se alcanza la temperatura de ebullición más baja de los componentes, este comienza a convertirse en vapor y pasa por el refrigerante, donde se enfriará y condensará. El líquido resultante, llamado destilado, se recoge en un recipiente (un vaso de precipitados, por ejemplo).

EVAPORACIÓN Y CRISTALIZACIÓN
Se emplea para separar un soluto sólido disuelto en un disolvente líquido, como la sal en el agua. El proceso comienza con la evaporación del disolvente (natural o forzada mediante calefacción) y acaba con la deposición en el fondo del recipiente (generalmente, un cristalizador) del sólido en forma de cristales. Cuanto más lenta sea la evaporación del disolvente, más grandes serán los cristales.

CROMATOGRAFÍA
Se usa para separar los componentes de una mezcla según la mayor o menor afinidad de cada uno de ellos por el disolvente empleado.
Una de las técnicas más sencillas es la cromatografía en papel, en la que se utiliza una tira de papel de filtro.

SEMANA #26
Porcentaje de eficiencia
Eficiencia de una reacción. La cantidad de producto que se suele obtener de una reacción química, es siempre menor que la cantidad teórica. Esto depende de varios factores, como la pureza del reactivo y de las reacciones secundarias que puedan tener lugar. Lograr una reacción 100%eficiente es prácticamente imposible.1
SEMANA #24
En este tipo de reacciones dos o más sustanciasse combinan para formar un solo producto. Los reactivos pueden ser elementos o compuestos, pero el producto siempre es un compuesto. En
este tipo de reacciones hay un solo reactivo, el cual se descompone en uno o más productos.
Básicamente podemos clasificar las reacciones químicas en:
a) Reacción de síntesis o adición
b) Reacción de análisis o descomposición
c) Reacción de desplazamiento o simple sustitución
d) Reacción de doble desplazamiento o doble sustitución
Reacción de Síntesis o Adición
Es cuando una o más sustancias reactivas producen apenas una única.
SEMANA #23
Que es una reaccion redox:
Una reacción redox (o de oxidación-reducción) es un tipo de reacción química en donde se transfieren electrones entre dos especies
El método del cambio de los números de la oxidación es relativamente sencillo, y es un modo fácil de equilibrar las ecuaciones redox. Se basa en el hecho de que el aumento de los números de la oxidación de los reactantes que han sido oxidados tiene que ser idéntico a la disminución de los números de oxidación de los reactantes que han sido reducidos.
Una reacción redox (o de oxidación-reducción) es un tipo de reacción química en donde se transfieren electrones entre dos especies
El método del cambio de los números de la oxidación es relativamente sencillo, y es un modo fácil de equilibrar las ecuaciones redox. Se basa en el hecho de que el aumento de los números de la oxidación de los reactantes que han sido oxidados tiene que ser idéntico a la disminución de los números de oxidación de los reactantes que han sido reducidos.
SEMANA #22
Consultar:



 GAY-LUSSAC formuló en 1808 la ley de los volúmenes de combinación que lleva su nombre. Al obtener vapor de agua a partir de los elementos (sustancias elementales) se había encontrado que un volumen de oxígeno se une con dos volúmenes de hidrógeno formándose dos volúmenes de vapor de agua; todos los volúmenes gaseosos medidos en las mismas condiciones de presión y temperatura.
GAY-LUSSAC formuló en 1808 la ley de los volúmenes de combinación que lleva su nombre. Al obtener vapor de agua a partir de los elementos (sustancias elementales) se había encontrado que un volumen de oxígeno se une con dos volúmenes de hidrógeno formándose dos volúmenes de vapor de agua; todos los volúmenes gaseosos medidos en las mismas condiciones de presión y temperatura.




ley de la conservación de masa
ley de las proporciones definidas
ley de Dalton o proporciones
ley de gay-lussac o volúmenes de convinacion
Solución:
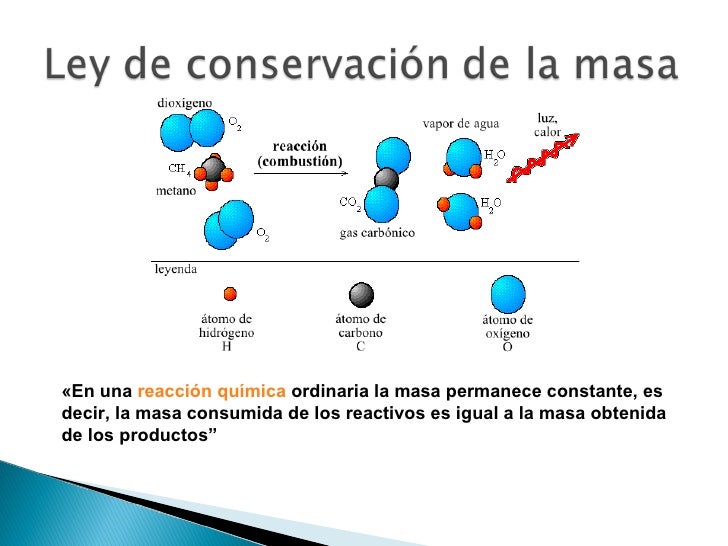
Ley de Lavoisier o ley de la conservación de la masa
“La masa no se crea ni se destruye, sólo se transforma”. En una reacción química la suma de la masa de los reactivos es igual a la suma de la masa de los productos.
Lavoisier demostró que al efectuarse una reacción química la masa no se crea ni se destruye, sólo se transforma, es decir, las sustancias reaccionantes al interactuar entre sí forman nuevos productos con propiedades físicas y químicas diferentes a las de los reactivos, esto debido a que los átomos de las sustancias se ordenan de forma distinta.
ley de conservación de la masa

los átomos ni se crean ni se destruyen, durante una reacción química. por lo tanto una ecuación química ha de tener el mismo numero de átomos de cada elemento a ambos lados de la fecha. se dice entonces que la ecuación esta balanceada
Ley de las proporciones múltiples (o de Dalton).
Las cantidades de un mismo elemento que se unen con una cantidad fija de otro elemento para formar en cada caso un compuesto distinto están en la relación de números enteros sencillos.
La ley de Proust no impide que dos o más elementos se unan en varias proporciones para formar varios compuestos. Así, por ejemplo, el oxígeno y el cobre se unen en dos proporciones y forman dos óxidos de cobre que contienen 79,90 % y 88,83 % de cobre. Si calculamos la cantidad de cobre combinado con un mismo peso de oxígeno, tal como 1g, se obtiene en cada caso:
Las dos cantidades de cobre son, muy aproximadamente, una doble de la otra y, por tanto, los pesos de cobre que se unen con un mismo peso de oxígeno para formar los dos óxidos están en la relación de 1 es a 2.
El enunciado de la ley de las proporciones múltiples se debe a DALTON, en 1803 como resultado de su teoría atómica y es establecida y comprobada definitivamente para un gran número de compuestos por BERZELIUS en sus meticulosos estudios de análisis de los mismos.
ley de gay-lussac o volúmenes de convinacion
Muchos de los elementos y compuestos son gaseosos, y puesto que es más sencillo medir un volumen que un peso de gas era natural se estudiasen las relaciones de volumen en que los gases se combinan.
En cualquier reacción química los volúmenes de todas las substancias gaseosas que intervienen en la misma, medidos en las mismas condiciones de presión y temperatura, están en una relación de números enteros sencillos.
Esta relación sencilla entre los volúmenes de estos cuerpos gaseosos reaccionantes no era un caso fortuito pues GAY-LUSSAC mostró que se cumplía en todas las reacciones en que intervienen gases tal como muestran los esquemas siguientes:
GAY-LUSSAC observó que el volumen de la combinación gaseosa resultante era inferior o a lo más igual a la suma de los volúmenes de las substancias gaseosas que se combinan.
La ley no se aplica a la relación entre los volúmenes de los cuerpos sólidos y líquidos reaccionantes tal como el volumen de azufre que se une con el oxígeno para formar anhídrido sulfuroso.
sábado, 12 de agosto de 2017
SEMANA # 21
TERCER PERIODO
ESTEQUIOMETRIA:
TEMAS: -Calculos Quimicos
-Soluciones
NO ESTEQUIOMETRICA
ECUACIÓN NO ESTEQUIOMETRICA
° - 2:1:2 -20=20
-4H=4H
lunes, 24 de julio de 2017
SEMANA # 18
Continúan las exposiciones, nos expone otro grupa el tema es: ENLACES QUÍMICOS Y ESTRUCTURA DE LEWIS.


ENLACES QUÍMICOS:
Es la interacción física responsable de las interacciones entre átomos, moléculas e iones
que tiene una estabilidad en los compuestos diatómicos y poliatómicos.
ESTRUCTURA DE LEWIS:
Es una representación gráfica que muestra los pares de electrones de enlaces entre los átomos de una molécula y los pares de electrones solitarios que puedan existir.


SEMANA # 17
En esta semana continuamos con las exposiciones, nos expuso otro grupo, el grupo fue el de juan jose.
Integrantes:
- Juan José Aristizábal Sarrazola.
- Luis Gustavo Zuñiga Ortega.
- Camilo Arango Villegas.
- Ricardo Rincón Echeverry.
Temas:
Tabla periódica:

GASES NOBLES:
Los gases nobles son un grupo de elementos químicos con propiedades muy similares: por ejemplo, bajo condiciones normales, son gases monoatómicos inodoros, incoloros y presentan una reactividad química muy baja.
ELEMENTOS DE TRANSICIÓN:
Casi todos los elementos de transición son metales típicos, de elevada dureza, con puntos de fusión y ebullición altos, buenos conductores tanto del calor como de la electricidad.
Integrantes:
- Juan José Aristizábal Sarrazola.
- Luis Gustavo Zuñiga Ortega.
- Camilo Arango Villegas.
- Ricardo Rincón Echeverry.
Temas:
Tabla periódica:
-Grupos
-Periodos
-Metales y no metales
-Elementos de transición.
-Gases nobles.
-Gases nobles.
Pregunta Problematizadora:
¿ Cómo lograr el entendimiento de la tabla periódica a través de una exposición con ayuda de las TIC?
GASES NOBLES:
Los gases nobles son un grupo de elementos químicos con propiedades muy similares: por ejemplo, bajo condiciones normales, son gases monoatómicos inodoros, incoloros y presentan una reactividad química muy baja.
ELEMENTOS DE TRANSICIÓN:
Casi todos los elementos de transición son metales típicos, de elevada dureza, con puntos de fusión y ebullición altos, buenos conductores tanto del calor como de la electricidad.
SEMANA # 15
Continuamos la exposición del grupo 1, de los elementos de la tabla periódica, este grupo expuso muy bien nos explicaron todo en una linea de tiempo.

SEMANA # 14
En esta semana se hizo lo de el día de la tierra, pero como yo no tenia computador el profesor me dio permiso de hacerlo en el cuaderno.

También se empezaron las exposiciones del grupo 1 sobre la tabla periódica.
martes, 2 de mayo de 2017
SEMANA #13
PRINCIPIO EXCLUCION DE PAULING

Dos electrones en un átomo no pueden tener idéntico número cuántico. Este es un ejemplo de un principio general que se aplica no sólo a los electrones, sino también a otras partículas de espín medio-entero.
PRINCIPIO DE MULTIPLICIDAD
todos los orbitales en una subcapa deben estar ocupados por lo menos por un electrón antes de que se le asigne un segundo. "Al llenar orbitales de igual energía (los tres orbitales p, los cinco d, o los siete f) los electrones se distribuyen, siempre que sea posible, con sus spines paralelos, es decir, separados.

Dos electrones en un átomo no pueden tener idéntico número cuántico. Este es un ejemplo de un principio general que se aplica no sólo a los electrones, sino también a otras partículas de espín medio-entero.
PRINCIPIO DE MULTIPLICIDAD
todos los orbitales en una subcapa deben estar ocupados por lo menos por un electrón antes de que se le asigne un segundo. "Al llenar orbitales de igual energía (los tres orbitales p, los cinco d, o los siete f) los electrones se distribuyen, siempre que sea posible, con sus spines paralelos, es decir, separados.
martes, 25 de abril de 2017
SEMANA #12
MODELO ACTUAL DEL ÁTOMO:
el modelo actual del atomo fue propuesto por 4 cientificos ganadores del premio novel es un modelo matematico:
heinsemberg
shrodinge
sommerfield
d.pauling
modelo actual del atomo esta formado por dos partes fundamentales , el nucleo y la corteza
necleo esta formado por los protones de cargas positiva (rutherfod ) y los neutrones (chadwik) en el nucleo se centra la mayor parte de la masa del atomo
corteza esta formada por los nivles y subniveles de energia, ya que los electrones no poseen la misma cantida de energia, los niveles aumentan su energia al aumentas el nuemero del nivel las le
los nucleos se denominan el numero cuantico principal (n) y toman los valores entre 1 en adelante
K-L-M-N-O-P-Q
NUMERO CUANTICO SECUNDARIO (1 O ASINUTAL)
son subniveles de energía, se representan por las letras minúsculas S, p,d,f cada nivel tiene igual numero de subniveles toman los valores entre cero y n-1
TERCER NUMERO CUANTICO se llama numero cuantico magnetico (m.l)
define la orientacion que pueden presentar orbitales de un mismo subnivel en relacion con un campo magnetico externo.para cada valor "l" -1 y +1
CUARTO NUMNERO CUANTICO (espin) (ms)
el electron presenta 2 tipos de movimientos 1 con respecto al nucleo y otro con respecto asu propiio eje
el modelo actual del atomo fue propuesto por 4 cientificos ganadores del premio novel es un modelo matematico:
heinsemberg
shrodinge
sommerfield
d.pauling
modelo actual del atomo esta formado por dos partes fundamentales , el nucleo y la corteza
necleo esta formado por los protones de cargas positiva (rutherfod ) y los neutrones (chadwik) en el nucleo se centra la mayor parte de la masa del atomo
corteza esta formada por los nivles y subniveles de energia, ya que los electrones no poseen la misma cantida de energia, los niveles aumentan su energia al aumentas el nuemero del nivel las le
los nucleos se denominan el numero cuantico principal (n) y toman los valores entre 1 en adelante
K-L-M-N-O-P-Q
NUMERO CUANTICO SECUNDARIO (1 O ASINUTAL)
son subniveles de energía, se representan por las letras minúsculas S, p,d,f cada nivel tiene igual numero de subniveles toman los valores entre cero y n-1
TERCER NUMERO CUANTICO se llama numero cuantico magnetico (m.l)
define la orientacion que pueden presentar orbitales de un mismo subnivel en relacion con un campo magnetico externo.para cada valor "l" -1 y +1
CUARTO NUMNERO CUANTICO (espin) (ms)
el electron presenta 2 tipos de movimientos 1 con respecto al nucleo y otro con respecto asu propiio eje
martes, 28 de marzo de 2017
SEMANA #11
SEGUNDO PERIODO
MODELOS ATÓMICO
-MODELO ATÓMICO DE LOS GRIEGOS ( IMAGEN)
-MODELO DE DALTON
- EL DESCUBRIMIENTO DEL ELECTRÓN
- MODELO DE THOMPSON
- EL DESCUBRIMIENTO DEL PROTON Y EL NÚCLEO
- EL MODELO DE RUTHERFORD
- MODELO DE BORH
DESARROLLO
- MODELO ATÓMICO DE LOS GRIEGOS:
La palabra átomo fue nombrada por primera vez en Grecia cerca del año 500. a.c por los atomistas, siendo los más destacados Demócrito y su mentor Leucipo.
-Los átomos son eternos, indivisibles, homogéneos, incompresibles e invisibles.
- Los átomos se diferencian solo en forma y tamaño, pero no por cualidades internas.

-MODELO DE DALTON:
El modelo atomico de jonh dalton surgido en el contexto de la química, fue el primer modelo atómico con bases científicas, propuesto entre 1803 y 1807 por jonh dalton aunque el autor lo denominó más propiamente teoría atómica o postulados atómicos.
EL DESCUBRIMIENTO DEL ELECTRÓN:
|
los gases son aislantes para voltajes bajos, sin embargo frente a voltajes elevados se vuelven conductores. cuando enuntubo de vidrio que contiene gas se hace parcialmente el vacio y se aplica un voltaje miles de voltios.
31 de marzo
consulta
* comportamiento dual de la luz : fotografían por primera vez el comportamiento dual de la luz. mediante un microscopio electrónico se a obtenido una instantánea que refleja , al mismo tiempo el comportamiento ondulatorio y corpuscular de la luz .
La idea de encerrar la explicación del universo en una sola y simple teoría se hace presente en el que hacer científico y esto es lo que intenta hacer Broglie incorporando los conceptos de onda y partícula para definir los fenómenos de la materia y la energía, una teoría universal.
Las partículas se pueden comportar como ondas y las ondas como partículas, el problema que presenta es que no se ha podido observar comportamiento ondulatorios a las partículas.
La idea de encerrar la explicación del universo en una sola y simple teoría se hace presente en el que hacer científico y esto es lo que intenta hacer Broglie incorporando los conceptos de onda y partícula para definir los fenómenos de la materia y la energía, una teoría universal.
Las partículas se pueden comportar como ondas y las ondas como partículas, el problema que presenta es que no se ha podido observar comportamiento ondulatorios a las partículas.

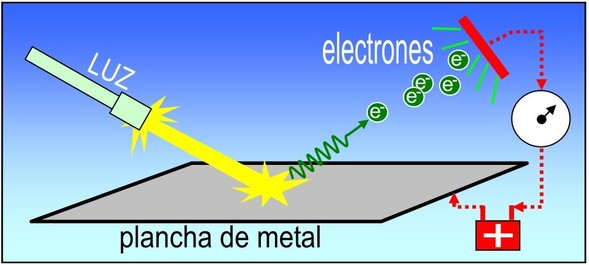
* efecto fotoeléctrico: consiste en la emisión de electrones por un material al incidir sobre él una radiación electromagnética.
El efecto fotoeléctrico fue descubierto y descrito por heinrich hertz en 1887, al observar que el arco que salta entre dos electrodos conectados a alta tensión alcanza distancias mayores cuando se ilumina con luz ultravioleta que cuando se deja en la oscuridad. Se podría decir que el efecto fotoeléctrico es lo opuesto a los rayos x ya que el efecto fotoeléctrico indica que los fotones pueden transferir energía a los electrones.
* principio de incertidumbre de heisenbereg: El principio de incertidumbre de Heisenberg, también conocido la relación de indeterminación , afirma la imposibilidad de realizar la medición precisa de la posición y del momento lineal (cantidad de movimientos) de una partícula al mismo tiempo. Esto produce que las partículas, en su movimiento no tienen una trayectoria definida.
Heisenberg presentó su modelo atómico, negándose a describir al átomo como un compuesto de partículas y ondas, ya que pensaba que cualquier intento de describir al átomo de dicha manera fracasaría. El prefería hacer referencia a los niveles de energía o a las órbitas de los electrones, usando términos numéricos, utilizando lo que llamo mecánica de matriz.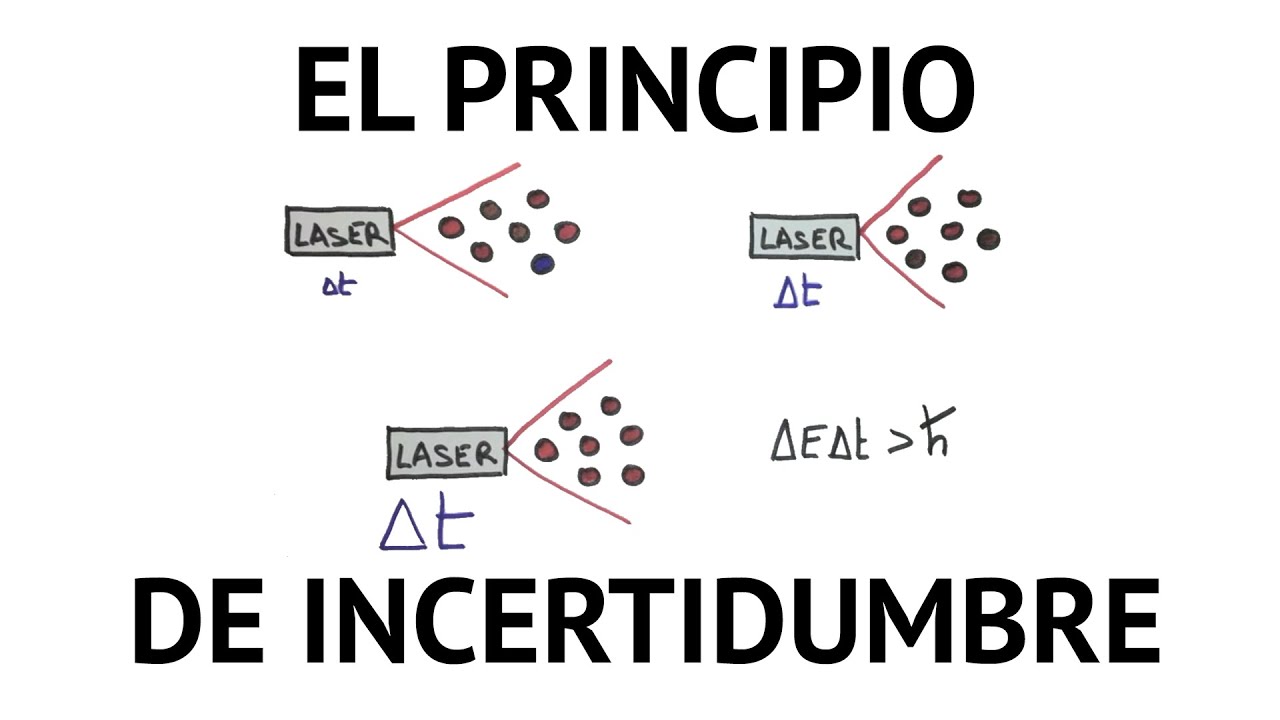
* partícula de dios: es una partícula elemental propuesta en el modelo estándar de física de particulas. Recibe su nombre en honor a peter higgs quien, junto con otros, propuso en 1964 el hoy llamado mecanismo de higgs para explicar el origen de la masa de las partículas elementales. El bosón de Higgs constituye el cuanto del campo de higgs , la más pequeña excitación posible de este campo. Según el modelo propuesto, no posee espín , carga electrica o color, es muy inestable y se desintegra rápidamente: su vida media es del orden del zeptosegundo. En algunas variantes del Modelo estándar puede haber varios bosones de Higgs.
Suscribirse a:
Comentarios (Atom)








