ley de la conservación de masa
ley de las proporciones definidas
ley de Dalton o proporciones
ley de gay-lussac o volúmenes de convinacion
Solución:
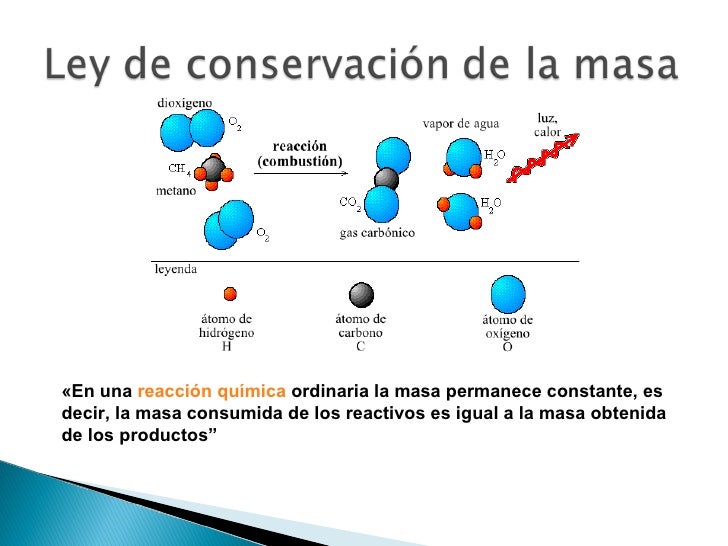
Ley de Lavoisier o ley de la conservación de la masa
“La masa no se crea ni se destruye, sólo se transforma”. En una reacción química la suma de la masa de los reactivos es igual a la suma de la masa de los productos.
Lavoisier demostró que al efectuarse una reacción química la masa no se crea ni se destruye, sólo se transforma, es decir, las sustancias reaccionantes al interactuar entre sí forman nuevos productos con propiedades físicas y químicas diferentes a las de los reactivos, esto debido a que los átomos de las sustancias se ordenan de forma distinta.
ley de conservación de la masa
los átomos ni se crean ni se destruyen, durante una reacción química. por lo tanto una ecuación química ha de tener el mismo numero de átomos de cada elemento a ambos lados de la fecha. se dice entonces que la ecuación esta balanceada
Ley de las proporciones múltiples (o de Dalton).
Las cantidades de un mismo elemento que se unen con una cantidad fija de otro elemento para formar en cada caso un compuesto distinto están en la relación de números enteros sencillos.
La ley de Proust no impide que dos o más elementos se unan en varias proporciones para formar varios compuestos. Así, por ejemplo, el oxígeno y el cobre se unen en dos proporciones y forman dos óxidos de cobre que contienen 79,90 % y 88,83 % de cobre. Si calculamos la cantidad de cobre combinado con un mismo peso de oxígeno, tal como 1g, se obtiene en cada caso:
Las dos cantidades de cobre son, muy aproximadamente, una doble de la otra y, por tanto, los pesos de cobre que se unen con un mismo peso de oxígeno para formar los dos óxidos están en la relación de 1 es a 2.
El enunciado de la ley de las proporciones múltiples se debe a DALTON, en 1803 como resultado de su teoría atómica y es establecida y comprobada definitivamente para un gran número de compuestos por BERZELIUS en sus meticulosos estudios de análisis de los mismos.
ley de gay-lussac o volúmenes de convinacion
Muchos de los elementos y compuestos son gaseosos, y puesto que es más sencillo medir un volumen que un peso de gas era natural se estudiasen las relaciones de volumen en que los gases se combinan.
En cualquier reacción química los volúmenes de todas las substancias gaseosas que intervienen en la misma, medidos en las mismas condiciones de presión y temperatura, están en una relación de números enteros sencillos.
Esta relación sencilla entre los volúmenes de estos cuerpos gaseosos reaccionantes no era un caso fortuito pues GAY-LUSSAC mostró que se cumplía en todas las reacciones en que intervienen gases tal como muestran los esquemas siguientes:
GAY-LUSSAC observó que el volumen de la combinación gaseosa resultante era inferior o a lo más igual a la suma de los volúmenes de las substancias gaseosas que se combinan.
La ley no se aplica a la relación entre los volúmenes de los cuerpos sólidos y líquidos reaccionantes tal como el volumen de azufre que se une con el oxígeno para formar anhídrido sulfuroso.
No hay comentarios:
Publicar un comentario